Abstract
Chronic hepatitis B and C are the most important cause of chronicliver disease in Korea. The ultimate goals of antiviral treatment are to decrease mortality from liver disease and lengthen survival by preventing viral replication and alleviating hepatic inflammation and by preventing the progression of fibrosis, development of liver cirrhosis, and hepatocellular carcinoma. In this article, we summarize antiviral treatment of chronic hepatitis B and C based on the recently updated guidelines suggested by the Korean association for the study of the liver, and American association for the study of liver disease. Keywords: Chronic, Hepatitis, Hepatitis B virus, Hepatitis C virus, Treatment
1. 만성 B형간염
1) 서론
B형 간염은 전 세계적으로 2억 5천7백만 명 이상의 만성 감염자가 있고 매년 88만 7천 명 이상이 관련 질환으로 사망하는 중요한 질환이다. 우리나라에서도 간염 및 간경변증 환자의 약 70%, 간세포암종 환자의 약 65-75%에서 HBsAg이 검출되고 있어 국민 건강에 미치는 영향이 매우 크다.
만성 B형간염은 감염후에 다양한 면역 상태를 보여주고 있어 단 1회의 검사를 통하여 해당하는 임상 단계를 단정 짓거나 항바이러스 치료 시작을 결정하는 것이 부적절한 경우가 많다.(Figure.1)
만성 B형간염 환자에서는 음주력, 약물 복용력 및 HBV 감염과 간세포암종의 가족력을 확인하고 다른 바이러스의 동반감염을 배제하기 위해 면밀한 병력 청취와 신체검사가 필요하고, 비만, 당뇨, 대사증후군 등의 동반질환이 있는지 평가하고, 정기적인 장기 추적 관찰이 필요하다.
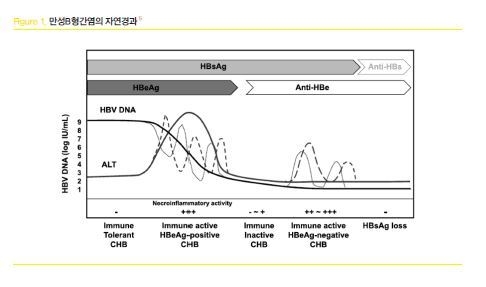
2) 치료 목적과 목표
만성 B형간염의 궁극적인 치료의 목적은 HBV증식을 억제하여 염증을 완화시키고 섬유화를 방지하여, 간경변증과 간세포암종 발생을 예방함으로써 간질환에 의한 사망률을 낮추고 생존율을 향상시키는 것이다.
치료목적 달성을 위한 임상적인 치료 목표는 ALT 정상화(남성 34IU/L, 여성 30IU/L 이하), 혈청 HBV DNA 불검출, HBeAg 혈청소실 및 전환, HBsAg 혈청소실 및 전환이다. 특히 HBsAg혈청소실 및 전환이 B형간염 치료의 이상적인 목표이다. 하지만 현재까지의 항바이러스 치료제는 치료에도 불구하고 핵 내의 cccDNA가 지속되어 HBV의 완전 퇴치를 기대하기 어렵기 때문에 바이러스반응을 장기간 유지하는 것이 중요하다.
3) 치료대상과 초기 평가
항바이러스 치료 시작을 결정하는 데에는 다양한 요소들이 고려되어야 하는데, 크게 1) 간질환의진행 정도, 2) B형간염 바이러스의 증식정도, 그리고 3) 간손상의 동반 여부에 따라 치료 시작 여부가결정된다.(Figure.2)
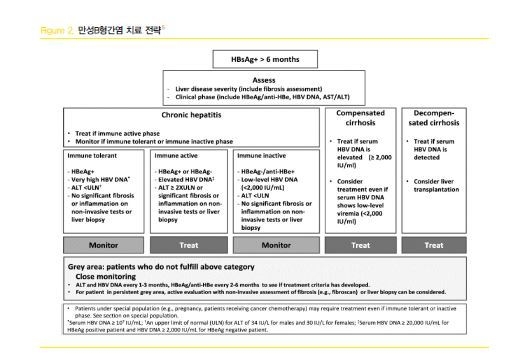
간질환의 진행정도는 만성간염, 대상성 간경변증, 비대상성 간경변증 상태로 크게 분류할 수 있다. B형간염 바이러스의 증식 정도는 혈청 HBV DNA PCR 검사를 통하여 확인할 수 있다. 간손상의 동반 여부 확인에는 혈청 ALT가 주로 활용되며, 간생검을 통해서 염증괴사 동반 여부를 확인할 수 있다.
초기 평가로 일반혈액검사(CBC), 혈청 AST/ALT, ALP, rGTP, bilirubin, albumin, creatinine,prothrombin time(PT)를 포함한 혈액검사가 필요하다. 또한 간염 치료 여부와 관계없이 간세포암종 동반 여부에 대한 검사를 시행하여야 하며, 감시검사로 6개월마다 정기적으로 복부 초음파검사, 혈청 알파태아단백검사(AFP)를 시행한다.
4) 치료 약제의 선택
2017년부터 국내에서 테노포비어 알라페나마이드 푸마르산(tenofovir alafenamide fumarate, 이하 테노포비어AF)와 베시포비어 디폭실 말레산(besifovir dipivoxil maleate, 이하 베시포비어)가 성인에서 만성 B형간염 치료제로 승인되어, 총8가지의 항바이러스제를 사용할 수 있다. 약제들은 크게 주사용 항바이러스제인 페그인터페론 알파와 경구용 항바이러스제로 나눌 수 있으며 경구용 항바이러스제는 내성발현의 유전자 장벽에 따라 두 부류로 나뉜다.
엔테카비어, 테노포비어DF, 테노포비어AF, 베시포비어는 HBeAg 양성 및 음성만성 B형간염 환자의 1차 치료약제로 권고된다. 페그인터페론은 고가이고 약제관련 부작용 등의 문제점이 있어 주로 HBV DNA가 높지 않으면서 간기능이 좋은, 젊은 연령의 환자들이 치료의 대상이 되고 48주 치료로 약 30% 정도의 지속적인 바이러스 반응을 기대할 수 있다.
테노포비어DF와 엔테카비어는 치료의 적응증이 되는 모든 환자에게 투여할 수 있으나 신기능 감소나 골대사질환이 있거나 질환의 위험이 있는 경우 초치료 경구용 항바이러스제를 결정할 때 테노포비어DF 보다는 엔테카 비어, 테노포비어AF, 베시포비어가 추천된다. 경구용 항바이러스제는 장기간 투여하여야 하는 단점이 있고 그에 따른 약제관련 부작용을 잘 모니터링하면서 치료해야 하며, 엔테카비어, 테노포비어DF는 효과와 장기간의 안전성이 검증되었으나 테노포비어AF, 베시포비어는 아직 장기 추적 데이터가 조금 더 필요하다.
5) 경구용 바이러스제 치료 중 모니터링
경구용 항바이러스제 치료 중에는 간기능검사 및 혈청 HBV DNA를 1-6개월 간격으로 검사하고 HBeAg/anti-HBe는 3-6개월 간격으로 검사할 수 있다. 또한 치료 중에 반응 예측과 종료 시점 결정에 도움을 줄 수 있는 HBsAg 정량검사를 고려할 수 있다. 바이러스 반응이 확인된 후에도 혈청 HBV DNA를 3-6개월 간격으로 지속적으로 측정하며 항바이러스 치료시 각각의 약물 부작용에 대한 모니터링이 필요하다.
경구용 바이러스제 사용중 치료 반응(Table1)은 약제에 순응도가 높은 환자에서 낮은 유전자 장벽을 가지고 있는 라미부딘, 텔비부딘과 같은 약제의 경우에는 치료 시작 후 24주째에, 엔터카비어, 테노포비어와 같이 높은 유전자 장벽을 가지고 있는 약제의 경우 48주에 바이러스가 검출되는 지에 따라 평가할 수 있다.
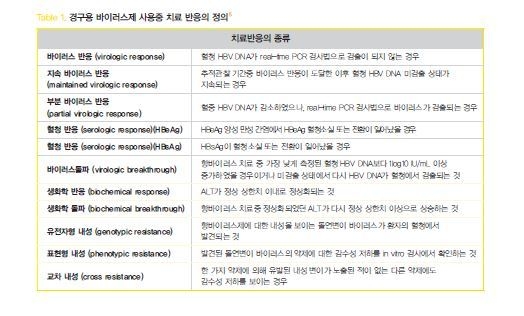
2. 만성 C형 간염
1) 서론
C형간염 바이러스는 전 세계적으로 3% 의 인구가 C형간염 바이러스에 감염되어 있는 것으로 추산되며 우리나라에서는 만성 간질환의 15-20% 원인을 차지하여 급, 만성간염, 간경변증 및 간세포 암종의 주요 원인 중 하나이다. 최근 수년간 C형 간염의 치료방향은 종전에 사용하던 주사제인 인터페론 없이 경구 투여약제인 직접작용항바이러스제 (direct acting antivirals, DAA)를 각 유전자형과 과거 치료 경험에 따라 병합 투약함으로써 부작용을 최소화하고, 치료기간이 비교적 짧으면서 치료 성공률은 90% 를 상회할 정도로 매우 높아 향후 C형간염 퇴치라는 이상적인 목표에 한결 근접하고 있다.
또한 2019 AASLD practice guideline에서 치료경험이 없는 만성 C형간염 및 대상성 간경변증 환자에서의 치료를 단순화하여 임상의가 환자를 치료하는데 보다 간결하고 명확한 지침을 제하고 있다. 복합제의 발전으로 인해 치료 경험이 없는, 만성 C형간염 및 대상성 간경변증 환자에서 유전자형에 관계없이 약제를 처방할 수 있게 되었다.
2) 치료 목적과 목표
만성 C형간염의 단기 치료 목표는 치료 종료 12주 또는 24주째 혈중 HCV RNA가 검출되지 않는 상태인 지속바이러스반응(sustained virological response, SVR)에 도달하는 것이다. 이를 통한 궁극적인 치료 목표는 HCV를 박멸하여 HCV 감염으로 인한 간경변증의 합병증, 간세포암종, 간외 합병증의 발생 및 이로 인한 사망을 예방하는 것이다.
3) 치료 대상
치료 여부는 간질환의 중증도, 간외 합병증, 치료 성공 확률, 심각한 부작용 발생 가능성, 동반 질환 유무, 환자의 치료 의지 등을 고려하여 개별화 해야겠으나 치료 금기가 없는 모든 C형간염 환자는 치료의 대상이며 특히 F3 이상의 진행된 섬유화를 동반한 환자와 간이식 전후의 환자는 우선적으로 치료한다.
4) 치료 약제의 선택
DAA는 C형간염 바이러스의 생활사에 직접작용하여 항바이러스 효과를 나타내며 작용 부위에 따라 HCV nonstructural protein(NS) 3/4A 단백분해효소억제제(protease inhibitor, PI), NS5A 억제제, NS5B 중 합효소억제제 등이 있다.
NS3/4A PI 는 HCV 증식에 필수적인 다단백 분해과정을 차단하며 asunaprevir, grazoprevir, glecaprevir, voxilaprevir 등 이 있다. NS5A 억제제는 HCV 복제 및 조립을 억제하며 daclatasvir, ledipasvir, ombitasvir, elbasvir, velpatasvir, pibrentasvir 등이 있다. NS5B 중합효소 억제제는 sofosbuvir와 dasabuvir가 있다. 현재까지 국내에서 승인된 DAA는 ledipasvir/sofosbuvir, sofosbuvir, daclatasvir, asunaprevir, ombitasvir/ paritaprevir/ritonavir, dasabuvir, elbasvir/ grazoprevir, glecaprevir/pibrentasvir가 있다.
DAA로 치료할 때 각 약제의 특성을 이해하고 간기능 및 콩팥기능 등을 고려하여 적절한 약제를 선택하며 다양한 약제와 약물상호작용을 유발할 수 있으므로 반드시 치료 전에 사용하고 있는 모든 다른 약제에 대하여 상호작용 여부를 확인해야한다. 여기서는 2019 AASLD practice guideline에서 변경된 부분에 대해서 소개하고자 한다.
(1) 치료 경험이 없는 만성 C형간염 환자
먼저 간경변증의 유무를 확인한다. 이를 위해 간조직검사가 필수적인 것은 아니며 FIB-4 score,transient elastography, 비침습적인 혈청학적 검사, 간경변증의 임상적 증거로 확인할 수 있다. 치료 경험이 없는 만성 C형간염 환자는 유전자형에 관계없이 glecaprevir/pibrentasvir 8주 치료 또는 sofosbuvir/velpatasvir 12주 치료를 시행한다. 단 한국에서는 sofosbuvir/velpatasvir가 아직 도입이 되지 않아 사용이 힘든 상황이다.
(2) 치료 경험이 없는 대상성 간경변증 환자
위와 같이 간조직검사 또는 비침습적 검사를 통해 간경변증 유무를 확인한다. 대상성 간경병증은 Child-pugh A등급인 경우에 해당한다. 치료 경험이 없는 대상성 간경변증 환자는 2019 AALSD practice guideline에서 유전자형에 관계없이 glecaprevir/pibrentasvir 8주 치료를 시행하는 것으로 되어 있으나, 아직까지 국내 보험기준으로는 대상성 간경변이 동반된 유전자형 3형의 경우에 12주 치료를 시행하는 것으로 되어있다.
한국에서 아직 도입이 되지 않은 Sofosbuvir/velpatasvir 치료 시에는 유전자형 3형을 제외하고 12주 치료를 한다. 유전자형 3형에서는 resistance-associated substitution (RAS) 검사를 시행해야 하며 NS5A Y93H RAS가 없으면 sofosbuvir/velpatasvir 12주 치료를 시행하고 NS5A Y93H RAS가 있다면 glecaprevir/pibrentqasvir 치료나 대체요법으로 치료를 시행해야 한다.
5) 치료 중 및 치료 종료 후 모니터링
치료 효과에 약제 순응도가 큰 영향을 미치기 때문에 치료중에는 약제 순응도를 정기적으로 확인하여야 하며, 치료 중 새로운 약제를 사용하게 되는 경우 약제 간 상호작용을 반드시 확인해야 한다. 치료 반응에 따른 요법을 위해 평가하는 급속 바이러스 반응(rapid virological response, RVR)은 치료 4주째 검출 한계 50 IU/mL 이하의 예민한 검사법으로 혈중 HCV RNA가 검출되지 않는 상태이며, 조기 바이러스 반응(early virological response, EVR)은 치료 12주째 혈중 HCV RNA가 치료 전 기저값에 비해 2 log 이상 감소하거나 검출 한계 50 IU/mL 이하의 예민한 검사법으로 검출되지 않는 상태로 정의한다.
치료 종료 12주 또는 24주째 예민한 검사법으로 혈중 HCV RNA가 검출되지 않는 상태를 SVR로 정의하며 최근 연구에서 치료 종료 12주째 평가한 SVR과 치료 종료24주에 평가한 SVR의 일치율이 치료 약제와 관계없이 98%로 알려져 있다. 치료 중 소실되었던 혈중 HCV RNA가 재출현하면 바이러스 돌파현상 (breakthrough), 치료 종료 후 소실되었던 혈중 HCV RNA가 재출현하면 재발(relapse)로 정의한다.
만성 C형간염에 대한 항바이러스 치료의 효과를 평가하기 위하여 치료 종료 후 12주 또는 24주째에 HCV RNA 농도를 측정하여 SVR 도달 여부를 확인하여야 하며, SVR에 도달한 경우에도 치료전에 진행된 간섬유화가 있으면 간세포암종 감시검진과 간경변증의 일반 합병증 관리가 필요하다. 더불어 SVR에 도달하지 못한 경우, 만성간염 및 간경변증에 준한 관리가 필요하다.
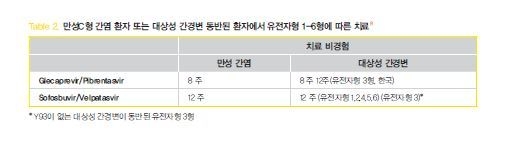
3. 결론
DAA 개발로 만성C형간염은 완치를 바라볼 수 있게 되었지만, 아직 만성 B형 간염은 현재까지의 항바이러스 치료제 치료에도 불구하고 완전 퇴치를 기대하기 어렵다. 때문에 최근에 전 세계적으로 국가기관, 산업체, 학계, 연구 재단 등이 힘을 합쳐 HBV 완치를 목표로 협업하는 기구인 International Coalition to eliminate HBV (ICE-HBV)가 2016년 설립하는 등, B형간염 완치를 위한 전세계적인 노력이 계속되고 있다.
ICE-HBV에서 현재 HBV 완치를 위한 가장 중요한 두 가지 전략으로 영구적으로 cccDNA를 제거, 그리고 HBV
에 감염된 간세포를 안전하게 제거할 수 있는 충분한 면역반응을 유도하는 것을 제시하고 있다. 이와 관련되어 직접작 용 항바이러스제(Direct acting antivirals, DAA) 및 숙주 면역 조절 반응(간접 작용 항 바이러스제, indirect acting antivirals, IDAAs)을 목표로 30개 이상의 후보약제가 연구 중에 있으며, 가장 유망한 치료 전력으로는 직접 작용제와 간접 작용제가 모두 결합된 항바이러스 치료제가 포함될 가능성이 높아 추후에 만성 B형간염도 완치를 바라볼 수 있는 시기가 올 것으로 기대된다.
또한 C형간염은 완치개념의 치료제가 나와있는 현실에서 현재 시행되지 않는 C형간염에 대한 국가검진을 확대 시행하여 환자를 찾아내고 치료를 한다면 한국에서도 C형간염이 박멸되는 날이 올 것으로 생각된다.

