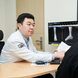
러닝 열풍이 이어지면서 봄철 걷기와 달리기를 즐기는 사람이 늘고 있다. 하지만 갑자기 운동을 과도하게 하면 발에 가해지는 부담이 커져 통증이나 부상으로 이어질 수 있다. 발에 생기는 통증 중 걷거나 달릴 때마다 발바닥이 찌릿하게 아프다면 족저근막염을 의심해봐야 한다. 족저근막염은 발바닥을 지지하는 족저근막에 반복적인 미세 손상이 누적되면서 염증이 생기는 질환이다. 방치하면 통증이 만성화돼 일상생활에 불편을 줄 수 있다. 강동경희대학교병원 정형외과 경민규 교수와 함께 족저근막염 증상, 치료법을 자세히 알아본다. 뒤꿈치 통증의 대표 원인, 족저근막염 족저근막은 뒤꿈치뼈에서 시작해 발바닥 앞쪽으로 가지를 내어 발가락 기저 부위에 붙은 두껍고 강한 섬유띠다. 발의 아치를 유지하고 충격을 흡수하며, 체중이 실렸을 때 발을 들어 올리는 데 도움을 준다. 보행 시 발의 움직임을 지탱하는 중요한 구조다. ▲ 강동경희대학교병원 정형외과 경민규 교수 이 족저근막에 반복적인 미세 손상이 가해지면 콜라겐 변성이 일어나고 염증이 발생하는데, 이를 족저근막염이라 한다. 성인의 뒤꿈치 통증을 유발하는 대표적인 원인 질환이다. 족저근막염, 최근 5년 꾸준히 증가 족저근막염은 최근 꾸준히 증가하는 추세다. 건강보험심사평가원 자료에 따르면 족저근막염(질병코드 M722, 발바닥근막성 섬유종증)으로 병원을 찾은 환자는 최근 5년간 약 15.4% 증가했다(2020년 25만829명→ 2024년 28만9,338명). 여성 환자(16만1,368명)가 남성(12만7,970명)보다 많았으며, 연령별로는 50대 환자가 7만269명으로 가장 많았고, 60대와 40대가 뒤를 이었다. 강동경희대학교병원 정형외과 경민규 교수는 “최근 족저근막염 환자 증가는 러닝 등 운동 증가로 발 사용이 과도해진 것도 영향을 준 것으로 보인다”고 말했다. 문제는 발의 ‘과도한 사용 ’족저근막염은 구조적으로 발바닥 아치가 낮은 편평족이거나, 반대로 아치가 높은 요족 변형이 있는 경우 발생 가능성이 높다. 하지만 실제로는 구조적 요인보다는 발을 무리하게 사용하는 생활 습관에서 비롯되는 경우가 많다. 평소 운동을 거의 하지 않던 사람이 갑자기 많은 양의 운동을 하거나, 장거리 러닝을 시작한 경우, 딱딱한 바닥에서 반복적인 충격 운동을 한 경우 족저근막염이 발생할 수 있다. 과체중, 장시간 서 있는 생활, 쿠션이 부족한 신발 착용, 하이힐 사용 등도 족저근막에 부담을 주는 요인이다. 아침 첫 발 디딜 때 가장 심한 통증 전형적인 증상은 아침에 일어나 처음 발을 디딜 때 느껴지는 뒤꿈치 통증이다. 밤사이 수축된 족저근막이 다시 늘어나면서 통증이 발생하는데, 주로 뒤꿈치 안쪽에서 나타나며, 발가락을 발등 쪽으로 구부릴 때 심해진다. 가만히 있을 때는 통증이 없지만 움직이면 아프고, 일정 시간이 지나면 다시 줄어드는 양상을 보이기도 한다. 질환이 진행되면 서 있을 때 뻣뻣한 느낌이 지속되고, 하루 일과가 끝날수록 통증이 점차 심해질 수 있다. 장기간 방치하면 보행이 불안정해지면서 무릎, 고관절, 허리 등 다른 관절에도 부담이 누적될 수 있어 주의가 필요하다. 치료의 기본은 휴식과 원인 교정 족저근막염은 대부분 보존적 치료로 좋아진다. 교정 가능한 원인을 바로잡는 것이 첫 단계다. 과도한 운동을 줄이고, 불편한 신발 착용을 피하는 등 족저근막에 가해지는 부담을 줄여야 한다. 통증이 있을 때는 며칠간 발을 쉬게 하고 냉찜질을 하는 것도 도움이 된다. 족저근막과 아킬레스건을 늘려주는 스트레칭은 가장 효과적인 치료 방법으로 알려져 있다. 필요에 따라 뒤꿈치 컵(Heel cup)이나 맞춤형 깔창을 사용해 발바닥에 집중되는 압력을 분산시킬 수 있다. 경민규 교수는 “족저근막염은 보존적 치료로 대부분 호전되지만 회복은 서서히 진행된다”며 “통증이 있다고 무리하게 운동을 지속하면 오히려 회복이 늦어질 수 있다”고 강조했다. 족저근막염 예방과 회복을 위한 생활 습관 족저근막염은 생활 습관 관리가 중요하다. 체중이 늘면 발바닥에 가해지는 부담이 커지므로 적절한 체중을 유지해야 한다. 운동은 갑자기 강도를 높이기보다 점진적으로 늘리는 것이 바람직하다. 신발 선택도 영향을 준다. 하이힐은 피하고, 충격 흡수가 가능한 쿠션 신발을 신는 것이 좋다. 밑창이 얇고 딱딱한 신발은 장시간 보행 시 통증을 악화시킬 수 있다. 규칙적인 스트레칭도 도움이 된다. 앉은 자세에서 엄지발가락을 잡아 발등 쪽으로 천천히 당겨 약 5~10분 유지하면 근막 이완에 효과적이다. 무엇보다 충분한 회복 시간을 갖고 무리하지 않는 것이 중요하다.