사람마다 가지고 있는 유전자 차이가 어릴 때 뇌가 자라나는 과정에서는 크게 문제가 되지 않지만, 나이가 들어서 치매 등 뇌 질환이 생길 때는 왜 어떤 사람이 더 잘 걸리는지 오랫동안 수수께끼였다. 국내 연구진이 최근 뇌 속 별아교세포가 면역 반응을 켜고 끄는 스위치를 지니고 있으며, 이 스위치를 조절하는 핵심유전자를 알아내고 성인이 된 후 뇌 질환에 대한 개인의 취약성을 결정한다는 점을 세계 최초로 밝혀냈다. 향후 알츠하이머병의 퇴행성뇌질환을 포함한 다양한 뇌 면역 반응의 원인 규명과 치료 전략의 중요한 단서를 제공했다.
 KAIST는 생명과학과 정인경 교수와 기초과학연구원(원장 노도영, IBS) 혈관 연구단 정원석 부연구단장(겸 KAIST 생명과학과 교수) 공동연구팀이 별아교세포(astrocyte) 발달 과정에서 특정 유전자가 성인기 뇌 면역 반응 조절에 핵심 역할을 한다는 사실을 세계 최초로 규명했다고 밝혔다.
KAIST는 생명과학과 정인경 교수와 기초과학연구원(원장 노도영, IBS) 혈관 연구단 정원석 부연구단장(겸 KAIST 생명과학과 교수) 공동연구팀이 별아교세포(astrocyte) 발달 과정에서 특정 유전자가 성인기 뇌 면역 반응 조절에 핵심 역할을 한다는 사실을 세계 최초로 규명했다고 밝혔다.
▲ (왼쪽부터) 정원석 교수, 박현지 박사과정,
박성완 박사, 정인경 교수
연구팀은 쥐 모델을 활용해 뇌·척수에 차지하는 비중이 높은 별아교세포의 발달 시기별 유전자 조절 프로그램을 정밀 분석한 결과, ‘NR3C1(Glucocorticoid Receptor)’ 유전자가 출생 직후 발달 단계에서 장기적 면역 반응 억제의 핵심 조절자임을 밝혀냈다.
연구팀은 최신 ‘3차원 후성유전체 분석 기술(DNA에 유전정보를 커짐·꺼짐분석 기술)’을 적용해 별아교세포 발달 과정에서의 전사체, 염색질 접근성, ‘3차원 게놈 상호작용(DNA가 공간 속에서 어떻게 접히고 서로 만나는지를 보는 기술)’을 통합 분석했다.
그 결과, 별아교세포가 자라나는 과정에서 55개의 중요한 유전자 조절 단백질(전사인자)을 찾아냈다. 그중에서도 NR3C1이라는 유전자가 아기 뇌가 처음 발달할 때 “가장 중요한 스위치” 역할을 한다는 사실을 밝혔다. 흥미로운 점은, 이 유전자가 없다고 해서 어릴 때 뇌 발달이 크게 망가지지는 않았다.
하지만 성인이 된 뒤 뇌에 자가면역성 질환(몸의 면역체계가 자기 뇌를 공격하는 병)을 일으키면, NR3C1이 없는 경우 뇌가 과도하게 염증 반응을 일으키고 병이 훨씬 심해졌다.
즉, NR3C1은 아기 뇌에서 “면역 스위치를 미리 켜둘 준비를 하는 엔진 예열 버튼”인 ‘후성유전적 프라이밍* 제어 역할을 하며, 이 덕분에 성인이 된 뒤 뇌가 과도한 면역 반응을 일으키지 않도록 지켜준다는 것을 알아냈다.
*후성유전적 프라이밍(epigenetic priming)유전자가 당장 발현되지 않더라도, 필요할 때 즉시 켜질 수 있게 스위치를 미리 준비해 두는 과정
정원석 IBS 부연구단장(KAIST 생명과학과 교수)은 “별아교세포의 면역 기능이 후성유전적 기억에 의해 조절된다는 사실을 처음 규명했다”며, “향후 알츠하이머병 등 퇴행성 뇌 질환의 원인 규명에 기여할 것”이라고 말했다.
KAIST 생명과학과 정인경 교수는 “이번 연구는 별아교세포 발달의 특정 시기(시간적 조절 창, window of susceptibility)가 성인기와 노인기 뇌 질환의 취약성을 좌우할 수 있음을 보여줬다”며, “게놈 3차원 구조 기반 연구가 다발성경화증(MS) 등 면역성 뇌 질환의 새로운 발병 원리 이해와 치료 전략 개발로 이어질 것”이라고 밝혔다.
이번 연구 결과는 KAIST 생명과학과 박성완 박사와 박현지 박사과정 학생이 제 1저자로 국제 학술지 네이처 커뮤니케이션스(Nature Communications, IF 15.7) 9월 22일자 온라인판에 게재됐다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부, IBS의 지원을 받아 수행됐다.
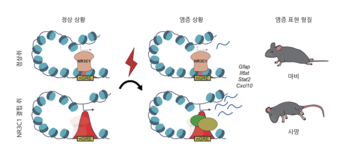
< 모식도는 NR3C1 유전자(글루코코르티코이드 수용체)가 별아교세포의 면역 반응을 어떻게 억제하는지를 보여준다. 정상(Control) 별아교세포에서는 NR3C1이 DNA의 특정 조절 부위(nGRE)에 결합해 면역 관련 유전자들의 발현을 억제함으로써, 면역 자극이 있어도 뇌의 균형이 유지된다. 반면, NR3C1이 제거된 별아교세포(KO)에서는 이러한 억제가 사라져 Gfap, Il6st, Stat2, Cxcl10과 같은 염증 관련 유전자들이 과도하게 활성화된다. 그 결과, 자가면역성 뇌질환 모델(EAE)에서 뚜렷한 신경 염증 악화와 임상 증상(마비 및 심각한 쇠약)이 나타난다. >
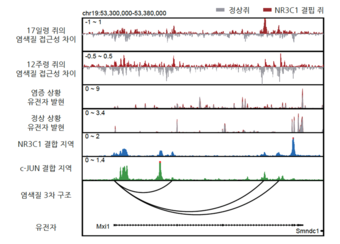
< 그림은 특정 유전자 영역에서 별아교세포의 3차원 게놈 구조를 보여주면서, NR3C1이 어떻게 이들 유전자 발현을 조절하는지를 보여준다. 정상 세포에서는 NR3C1이 DNA에 결합해 염색질 구조를 닫힌 상태로 유지하면서 원거리 조절 요소(인핸서)와 유전자 프로모터의 불필요한 활성화를 차단한다. 반면, NR3C1이 결여되면 염색질이 열리고, 인핸서와 유전자가 활성이 쉽게 일어날 수 있는 상태로 바뀌게 된다. 그 결과, Mxi1과 같은 유전자가 과도하게 발현되고 염증 반응이 촉발된다. 이는 NR3C1이 3차원 유전자 조절 기전을 안정적으로 유지해 면역 반응의 항상성 유지에 중요한 역할을 하는 사실을 잘 보여준다. >